第4回日本遺伝性乳癌卵巣癌総合診療制度機構(JOHBOC)学術総会
モーニングセミナー (2024年5月開催)

赤坂山王メディカルセンター 院長/国際医療福祉大学大学院 教授

琉球大学大学院医学研究科 女性・生殖医学講座 教授
登壇者のご所属は、記事作成時点での情報を記載しています。
BRCA遺伝子の同定、研究、臨床への実装化という約30年の道のりを経て、卵巣癌領域ではBRCA病的バリアントや相同組換え修復欠損(HRD)に基づく個別化治療が可能となりました。一方で、個別化治療を円滑に実践するには、遺伝学的検査や遺伝カウンセリングなどにおける課題が残されています。
本講演では、BRCAの研究に初期から取り組まれ(図1)、婦人科腫瘍と臨床遺伝の専門医でありJOHBOC登録部会オブザーバーの関根正幸先生に、最新の卵巣癌ゲノム医療、ゲノムに基づく個別化治療の課題、そしてBRCA遺伝子病的バリアント陽性者に対する日本人データに基づく遺伝カウンセリングの可能性についてお話しいただきました。

最新の卵巣癌ゲノム医療

卵巣癌領域ではPARP阻害薬の登場以降、予後不良とされてきた卵巣癌の長期予後をどれだけ改善できるかが課題となっています。
PARP阻害薬オラパリブの最新の臨床成績
まずはオラパリブ単剤維持療法の最新の成績を解説します。BRCA病的バリアントを有し、初回治療でプラチナ感受性を示した進行卵巣癌患者を対象としたSOLO1試験では、オラパリブ群はプラセボ群に対し3年無増悪生存期間(PFS)の有意な改善を示しました1)。2023年に報告された7年全生存率(OS)は、オラパリブ群(67.0%)がプラセボ群(46.5%)に比べ高い傾向を示しました(ハザード比[HR]0.55、95%信頼区間[CI]0.40–0.76、p =0.0004[有意水準p<0.0001])2)。
続いて一次化学療法(プラチナ製剤ベースの化学療法とベバシズマブの併用療法)に反応した進行卵巣癌患者へのオラパリブ・ベバシズマブ併用維持療法の効果を検討したPAOLA-1試験を紹介します3)。全体集団ではオラパリブ+プラセボ群に対しオラパリブ+ベバシズマブ群の5年OSに有意な差がなかったのに対し、HRD陽性集団ではオラパリブ+ベバシズマブ群で5年OSの改善が示されました(HR 0.62、95%CI 0.45–0.85)。
今後も、BRCA病的バリアントやHRDを有する卵巣癌患者に対するPARP阻害薬の長期成績に期待が持てそうです。
再々発卵巣癌に対するPARP阻害薬の再投与
さて、臨床では今、「再々発卵巣癌に対してPARP阻害薬の再投与は可能か」という点が問題となっているのではないでしょうか(図2)。
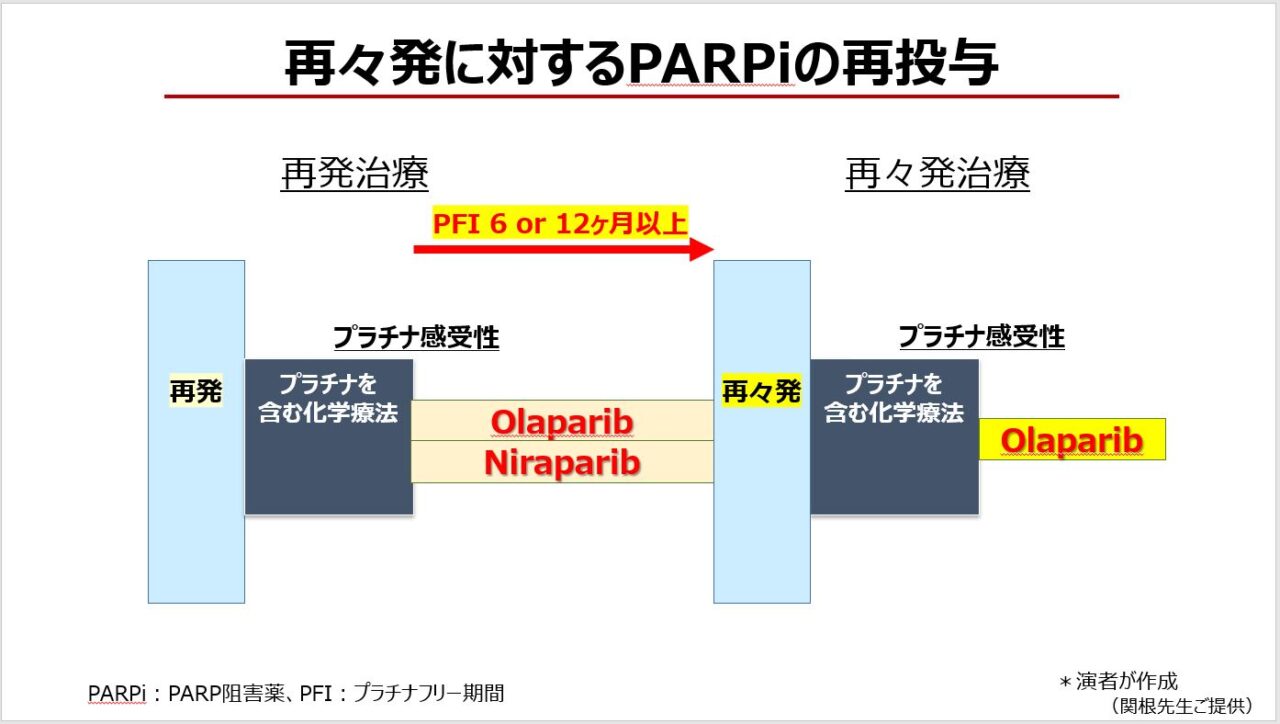
そこで、PARP阻害薬の再投与を検証した第3b相ランダム化二重盲検試験(OReO試験)を紹介します4)。本試験では、PARP阻害薬による維持療法歴のあるプラチナ感受性の卵巣癌再発患者を、BRCA病的バリアント陽性集団と陰性集団に分けたうえで、オラパリブ(維持療法)またはプラセボを投与しました。その結果、BRCA陽性・陰性集団ともに、オラパリブ群でPFSが有意に延長しました(BRCA陽性群: HR 0.57、95%CI 0.37–0.87、p=0.0220;BRCA陰性群:HR 0.43、95%CI 0.26–0.71, p=0.0023)。このように、オラパリブ再投与の有効性を示すデータが得られています。
ゲノムに基づく個別化治療の課題①: HRD検査
次にゲノムに基づく個別化治療の課題として、HRD検査の検体採取やスコアの解釈などを解説します。MyChoice診断システム®によるHRD検査では、3種類の解析(ヘテロ接合性の消失[LOH]、テロメアアレル不均衡[TAI]、大規模な状態遷移[LST])に基づいてゲノム不安定性(GI)スコア*を算出し、腫瘍検体がHRDであるかを判定します。GIスコアがカットオフ値の42以上かつ/または腫瘍のBRCA(tBRCA)病的バリアントが陽性の場合、HRD陽性と定義されます。
HRD検査における検体採取の課題
腫瘍検体の採取条件はHRD検査の課題の一つです。MyChoice診断システム®に用いる標本の基準は、ヘマトキシン・エオジン(HE)染色スライド1枚(厚さ5μm)+未染色スライド8枚以上(厚さ5μm;腫瘍表面積により必要枚数は異なる)、腫瘍含有割合は最低20%(推奨は30%以上)、3年以内に採取したサンプルが望ましい、とされています(図3)。
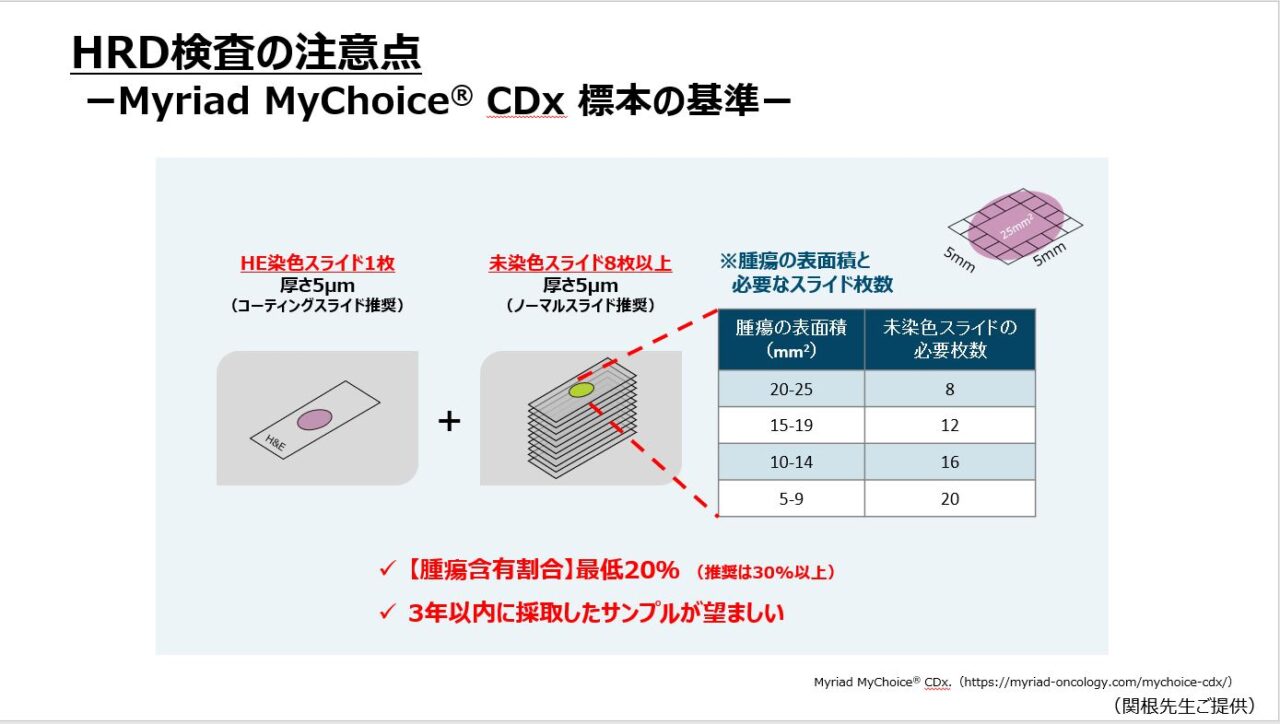
検体は、腫瘍含有量が多く化学療法の影響を受けていないことが望まれます。初回腫瘍減量手術でケモナイーブな腫瘍を採取できる場合はよいですが、ネオアジュバント化学療法を行う場合は事前に生検が必要になります。生検には審査腹腔鏡が望ましいですが、手術枠などの制限から針生検や腹水セルブロックを用いる施設も多いのではないでしょうか。これらの方法では十分な腫瘍量を確保するのが難しいという課題があります。また、化学療法後にしか腫瘍を採取できなかった場合、採取検体が腫瘍本来の特性(HRDなど)を反映していない場合があるという点も課題であり、今回の第4回 JOHBOC学術総会 シンポジウム1「婦人科領域:HRDの評価に関する最新の知見」 でも活発な議論がされていました。
GIスコアカットオフ値の課題
MyChoice診断システム®では、LOH・TAI・LSTの3種類の解析を組み合わせてGIスコアを算出していることは説明しましたが、これにより、GIスコアに対する卵巣癌症例の分布は二峰性を示し(症例数のピーク:スコア約20および約60)、ピークに挟まれた谷の辺りにカットオフ値(42)が位置します(図4)5)。一方、LOHスコアのみでHRDを判定する場合、症例は低スコアに分布しピークも二峰性を示さないため、カットオフ値の設定は困難に見えます。BRCA1/2の病的バリアント判定について、GIスコア(カットオフ値42)とLOHスコア(カットオフ値16%)を比較した研究では(対象:卵巣癌3,336検体)、陰性一致率が96.6%、陽性一致率が64.9%と報告されています6,7)。

次に、GIスコアのカットオフ値は42で妥当かを考えましょう。高異型度漿液性卵巣癌(HGSOC)のカットオフ値を検討したデータベース研究では、HGSOCの予後を識別する最適なカットオフ値は63であることが示唆されています8)。本研究ではThe Cancer Genome AtlasのHGSOC患者データを用いて、BRCA1/2病的バリアント(生殖細胞系列および体細胞)を有する患者がスコア63以上に集中していることを明らかにしました。さらに患者を3群(スコア:41以下、42~62、63以上)に分けてOSを比較したところ、41以下と42~62の群は同程度であったのに対し、63以上の群は他2群を上回るOSを示しました(p<0.0001)。このように、カットオフ値にはまだ検討の余地があると考えられます。
HRD検査の網羅性の課題
相同組換え修復は多くの関連遺伝子に基づく分子生物学的現象です。MyChoice診断システム®は、これらの関連遺伝子異常による「ゲノム不安定性」という結果の部分を検出する検査ですが、関連遺伝子のゲノム解析としてはBRCA1/2のみの解析を行っています。日本人の進行卵巣癌患者を対象とした観察研究(CHRISTELLE研究)では、進行卵巣癌患者(205名)におけるHRD陽性頻度は60%(tBRCA病的バリアント陽性26.8%、陰性33.2%)でした9)。BRCA以外の相同組換え修復関連遺伝子は、いまだ同定されていない遺伝子群の関与も示唆されており、そのゲノム異常を網羅的に検査することは難しく、今後の課題と考えられます。
HRD・BRCAの状態とPARP阻害薬感受性
さてHRDが陽性の場合、tBRCA病的バリアント陽性と陰性でPARP阻害薬の感受性に違いはあるのでしょうか。PRIMA試験では、プラチナ感受性の進行卵巣癌患者にニラパリブまたはプラセボを投与し、HRDとtBRCAの状態に基づいてサブグループ解析を行いました10)。ニラパリブ群の各サブグループのPFS中央値は、HRD陽性・tBRCA病的バリアント陽性が22.1ヵ月と最も長く、次いでHRD陽性・tBRCA病的バリアント陰性群が19.6ヵ月、HRD陰性(HRP)または不明は8.1ヵ月と最も短いことが示されました。このように、HRD検査はPARP阻害薬の感受性予測となり得ることがはっきりと示唆されています。
ゲノムに基づく個別化治療の課題②: BRCA病的バリアント陽性者に対する日本独自の対応

個別化治療のもう一つの課題として、BRCA陽性者に対して日本人を対象にしたエビデンスを用いて遺伝カウンセリングを行うことが可能かについて解説します。皆さんは、図5の家族歴を持つBRCA陽性者に対しどのようなカウンセリングをされますか。
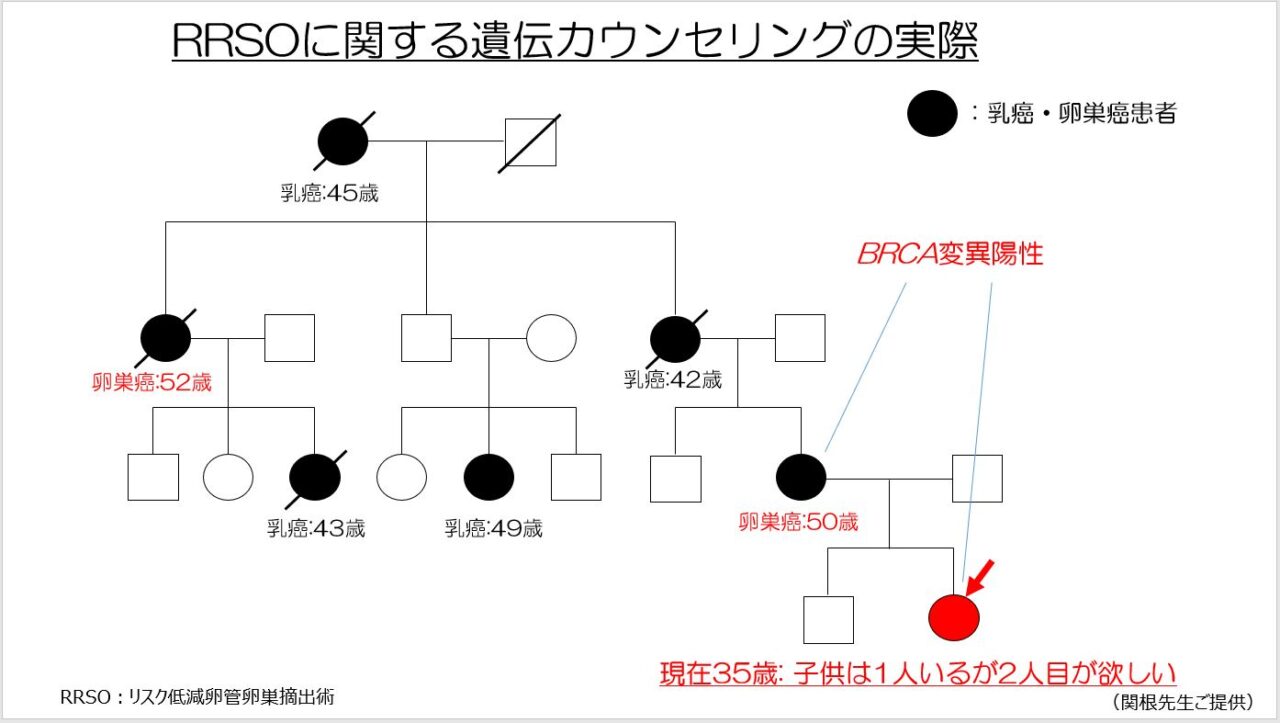
NCCNガイドライン11)などの欧米のエビデンスに基づくと、遺伝カウンセリングの概要は以下のようになるでしょう。しかし、欧米のエビデンスが日本人にも当てはまるのかという疑問があります。
- リスク低減卵管卵巣摘出術(RRSO)は、卵巣癌のリスクを80%、乳癌リスクを50%減少させることにより、総死亡率が減少します。
- BRCA1病的バリアント陽性の場合、40歳までにRRSOを行うことが推奨されています。
- BRCA2病的バリアント陽性の場合、45歳までが目安です。
- RRSO後も腹膜癌に注意が必要です。
- RRSO後も乳癌のリスクは残るので、リスク低減乳房切除術(RRM)を考慮すべきです。
- 経腟エコーと腫瘍マーカーCA125の検診(サーベイランス)は、明らかな卵巣癌死亡率の減少が認められていません。
- 他の予防手段として、ピル内服の選択肢もあります。
BRCA病的バリアントに基づく遺伝カウンセリング: 日本人データより
では、先ほどのクライアント(図5)のBRCA1病的バリアントがL63Xであると分かった場合、遺伝カウンセリングでの対応は変わるでしょうか。病的バリアントの型に基づく個別の遺伝カウンセリングがどこまで可能か考えてみましょう。
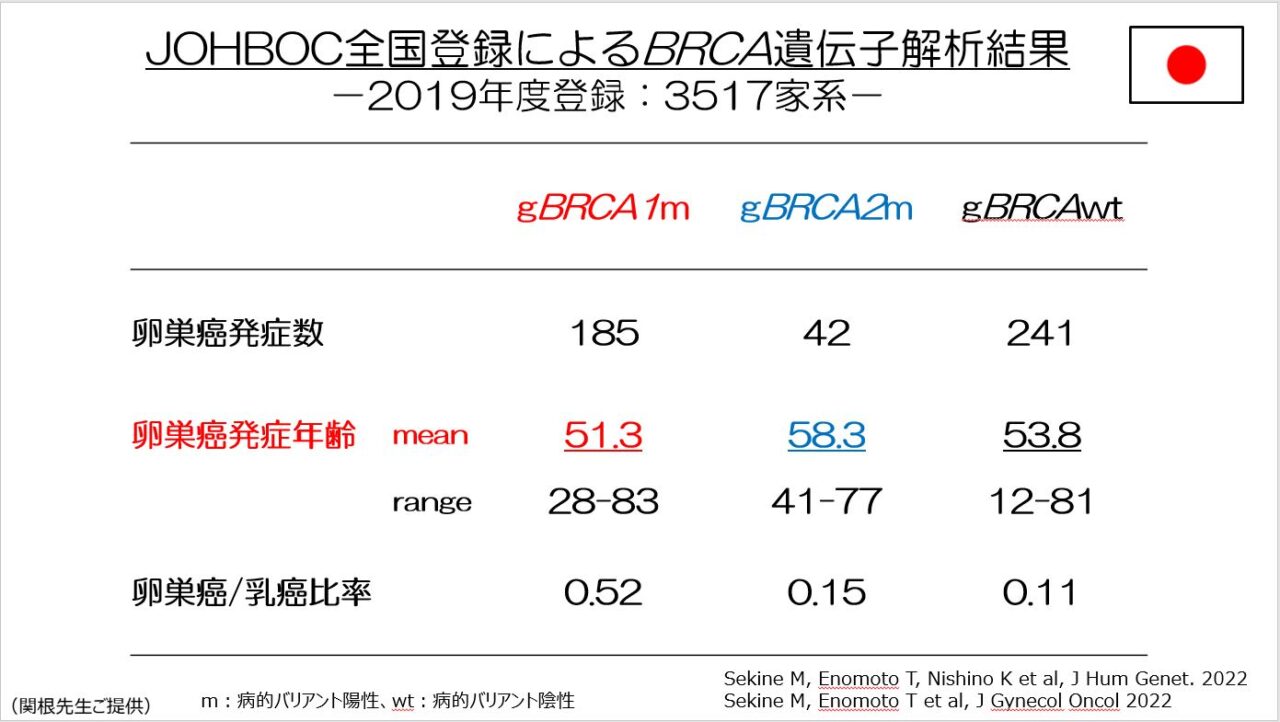
BRCA病的バリアントごとの日本人の卵巣癌・乳癌発症リスクを、JOHBOCの全国登録データベースを用いて解析しました12,13)。まず、gBRCA(生殖細胞系列)病的バリアントの有無で発症リスクを比較しました(図6)。卵巣癌の平均発症年齢は、gBRCA陰性(53.8歳†)と比べてgBRCA1病的バリアント陽性(51.3歳)では若年であり、gBRCA2病的バリアント陽性(58.3歳)では高齢でした。卵巣癌/乳癌比率は、gBRCA陰性(0.11)と比べてgBRCA1病的バリアント陽性(0.52)では高く、gBRCA2病的バリアント陽性(0.15)は一般集団での卵巣癌/乳癌比率(0.15)と変わりませんでした。また、gBRCA2病的バリアント陽性では40歳未満の卵巣癌発症者を認めていませんでした。本データより、日本人のgBRCA2病的バリアント陽性者は、卵巣摘出を40歳まで待つことができる可能性が示されました。ただしgBRCA2陽性者での乳癌発症は20代から認めるため、乳癌のリスク低減効果という観点もあわせて、卵巣摘出時期の検討が必要になります。
†JOHBOCデータベースには家族歴が濃厚な患者が多く含まれるため、gBRCA陰性患者であっても一般集団より若年発症である可能性があります。
次にBRCA病的バリアントの型ごとに発症リスクを比較しました(図7)12)。JOHBOCのデータによると、日本で多くの家系に見られるBRCA病的バリアント(上位2種類)は、BRCA1はL63XとQ934X、BRCA2はR2318XとSTOP1861でした。卵巣癌の発症年齢は、BRCA1、BRCA2ともに特定の病的バリアントによる有意な差は認められませんでした。一方で、卵巣癌/乳癌比率は、BRCA1ではQ934X(0.80)がBRCA1全体(0.52)に対して有意に高く、BRCA2ではR2318X(0.32)がBRCA2全体(0.15)より有意に高いことが示されました(p<0.05)。

これまでの遺伝カウンセリングはほぼ欧米のデータに基づき実施されてきましたが、日本人は卵巣癌・乳癌の発症年齢やリスク因子が欧米とは異なる可能性があります。したがって、日本人のデータに基づいて個別化した遺伝カウンセリングを行うことが理想の形だと考えます。そのためには、クライアントの希望(挙児希望などの人生設計)を重視し、家系内の卵巣癌・乳癌患者の発症年齢に目を配り、個々のBRCA病的バリアントに基づいて発症リスクを説明できるようになることが望ましいと思います。
座長からのメッセージ

本日は卵巣癌ゲノム医療の現状と課題、そしてBRCAの膨大な解析結果をご説明いただきありがとうございました。これだけ多くの家系数を解析されたのは、日本ではおそらく関根先生だけではないでしょうか。改めて、大変貴重な研究結果であると感じました。今後も研究を積み重ねていただき、ぜひ新たな知見を発表していただければと思います。
関根先生、ありがとうございました。
【出典】
1) Moore K, et al. N Engl J Med. 2018;379(26):2495-2505.
2) DiSilvestro P, et al. J Clin Oncol. 2023;41(3):609-617.
3) Ray-Coquard I, et al. Ann Oncol. 2023;34(8):681-692.
4) Pujade-Lauraine E, et al. Ann Oncol. 2023;34(12):1152-1164.
5) Mills GB, et al. SGO 47th Annual Meeting (abstract: Gynecol Oncol. 2016;141(suppl. 1):S2-3.
6) Timms KM et al., J Clin Oncol. 2020;38(15_suppl):1586.
7) Ngoi NYL, et al. ESMO Open. 2021;6(3):100144.
8) Takaya H, et al. Sci Rep. 2020;10(1):2757.
9) Oda K, et al. Cancer Sci. 2023;114(1):271-280.
10) González-Martín A, et al. N Engl J Med. 2019;381(25):2391-2402.
11) National Comprehensive Cancer Network®. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 3.2024
12) Sekine M, et al. J Hum Genet. 2022;67(5):267-272.
13) Sekine M, et al. J Gynecol Oncol. 2022;33(4):e46.



